Diese Aussage kennzeichnet das sich wandelnde Verständnis von zellulären Prozessen sehr treffend und illustriert die Zielsetzung der Forschungsarbeiten des Lehrstuhls mit dem biologischen System Pflanze: Die Charakterisierung biochemischer Netzwerke und die systematische Erfassung bisher unbekannter Kausalitäten in metabolischen und regulatorischen Funktionen der Pflanze in ihrer Umwelt. Die Funktionen lebender Zellen sind von einer enormen Komplexität und dem dynamischen Zusammenspiel unterschiedlicher Moleküle und Molekülklassen gekennzeichnet. Die Fortschritte auf dem Gebiet der „funktionellen Genomik“ erlauben uns, diese Komplexität in Ihrer räumlichen und zeitlichen Dimension zu begreifen. So ist es möglich, die Reaktionen aller Elemente einer Molekülklasse auf bestimmte Umweltveränderungen zu kartieren, und in hoher zeitlicher Auflösung die Dynamik in der biologischen Reaktion zu verstehen. Derartige Analysen haben belegt, dass biochemische Stoffwechselprozesse nicht als lineare Anordnungen von Enzymen zu begreifen sind, sondern als komplexes, sich gegenseitig beeinflussendes Netzwerk. Gleiches gilt für regulatorische Funktionen, mit denen lebende Zellen auf Signale reagieren, um die Expression ihrer Gene an veränderte Umwelt-Bedingungen anzupassen. Die Lücken in unserem Verständnis dieser Komplexität sind der Hauptgrund warum biotechnologische oder medizinische Modifikationen von biologischen Systemen oftmals unvorhersehbare Konsequenzen haben. Dies ist für biotechnologische und medizinische Anwendungen potenziell problematisch, z.B. wenn es darum geht bestimmte Metabolite in grossen Mengen herzustellen, die Biomasse und damit den Ertrag von Nutzpflanzen zu steigern, oder auch um Krankheiten effizient und ohne Nebenwirkungen zu bekämpfen.
Die Forschungsarbeiten des Lehrstuhls haben das Ziel, die Komplexität des Systems Pflanze besser zu verstehen und bisher unbekannte Kausalitäten zwischen regulatorischen und katalytischen Funktionselementen aufzudecken. Methodisch bedienen wir uns dabei einer Kombination aus Proteomik und der funktionellen Analyse biologischer Prozesse mit grundlegenden molekularbiologischen und biochemischen Methoden. Mit dieser Kombination zielen wir auf ein mechanistisches Verständnis zellulärer Prozesse ab. Die Proteomik, mit deren Hilfe wir die dynamischen Anpassungen von Proteinmengen und deren posttranslationalen Modifikationen in Antwort auf eine Störung des Systems analysieren, liefert dafür die Hypothesen. Die Systembiologie mit ihren Werkzeugen zur Modellierung biologischer Prozesse liefert den analytischen Rahmen.
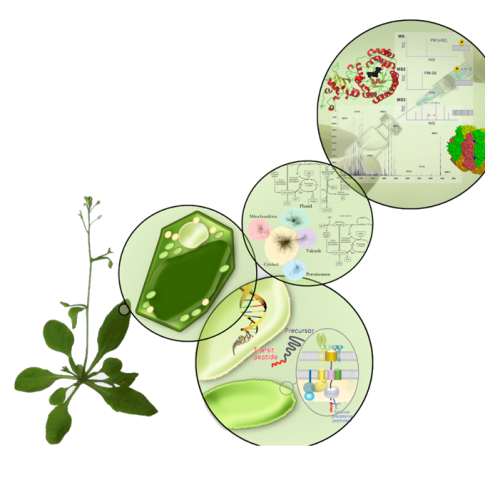
Im Fokus unserer Arbeiten stehen die Chloroplasten. Chloroplasten haben zentrale Bedeutung für den Aufbau von Biomasse und damit für landwirtschaftlichen Ertrag und Ernährungssicherung, da sie die Reaktionen der Photosynthese beherbergen. Darüber hinaus finden weitere essentielle Biosynthesen in Chloroplasten statt, z.B. die Biosynthese von Fettsäuren, Hormonen und einigen essentiellen Aminosäuren. Mit der Biosynthese von aromatischen Aminosäuren stellt der Chloroplast den Angriffspunkt für das umstrittene Herbizid Glyphosat dar. Wir wollen die Chloroplasten-Biogenese besser verstehen. Dazu untersuchen wir z.B., wie Chloroplasten Proteine importieren, welche Proteine sie enthalten, und wie ihre Funktionen dynamisch in Antwort auf veränderte Bedingungen reguliert werden, z.B. über posttranslationale Modifikationen. Zwei zentrale Protein-Modifikationen sind Phosphorylierung und Acetylierung, die sehr schnelle Anpassungen von Protein-Aktivitäten an veränderte Bedingungen ermöglichen und von spezifischen Enzymen katalysiert werden. Ein Ziel unserer Arbeiten besteht darin, den modifizierenden Enzymen ihr spezifisches Spektrum an Zielproteinen zuzuordnen und den funktionellen Einfluss einer Modifikation auf das modifizierte Enzym zu verstehen. Chloroplasten sind funktionell eng mit den regulatorischen Prozessen im Zellkern und dem Zytoplasma verbunden. Wir konnten zeigen, dass zytosolischer Protein-Abbau über das sog. Proteasom den Aufbau des Photosynthese-Apparates kontrolliert und unter ungünstigen Bedingungen limitiert. Dabei gilt allerdings das Prinzip des «safety first», d.h. diese Limitierungen greifen bereits bei relativ guten Bedingungen und schränken damit die Synthese von Biomasse signifikant ein. Wir wollen verstehen, unter welchen Bedingungen diese Kontrolle einsetzt, welche Mechanismen zu ihrer Regulation existieren und wie stark die Beeinflussung des Biomasseaufbaus ist.